【重点关注】我院肿瘤研究所最新研究成果发表于国际生物物理1区期刊BBA - Molecular Basis of Disease
 473
供稿:本站
473
供稿:本站
近日,我院肿瘤研究所最新研究论文“Cancer-associated fibroblasts facilitate DNA damage repair by promoting the glycolysis in non-small cell lung cancer”发表于国际生物物理一区期刊:BBA - Molecular Basis of Disease。该论文率先在国际上揭示了CAFs通过调控糖酵解对NSCLC细胞DNA损伤修复响应的影响。

肺癌是我国发病率、死亡率均居于首位的恶性肿瘤,其中非小细胞肺癌(Non-small cell lung cancer, NSCLC)约占全部肺癌的85%。放疗作为一种积极有效的局部治疗手段,既可用于早期和局部晚期肺癌的根治性治疗,也可用于晚期肺癌的姑息性治疗。然而,放疗抵抗性的存在严重影响了患者的治疗效果。
以往对肺癌放疗抵抗性的研究多着眼于癌细胞自身,而忽略了肿瘤微环境的重要影响。肿瘤相关纤维细胞(Cancer-associated fibroblasts, CAFs)是肿瘤微环境的主要成员,与肿瘤的发生发展密切相关,越来越多的证据表明,CAFs通过多种机制决定肿瘤细胞对放化疗的反应。通过与周围肿瘤细胞的信号传导,CAFs为肿瘤细胞创造了一个对抗死亡刺激的“保护罩”。
另一方面,由于增强的DNA修复能力和抗氧化潜力,CAFs本身对放化疗表现出高抵抗性。因此,靶向CAFs是治愈人类癌症的一种重要途径。
此次发表的研究论文题为“Cancer-associated fibroblasts facilitate DNA damage repair by promoting the glycolysis in non-small cell lung cancer”,率先在国际上揭示了CAFs通过调控糖酵解对NSCLC细胞DNA损伤修复响应的影响。论文由我院肿瘤研究所张红芳副研究员为第一作者,肿瘤放射治疗科二病区张珂主任医师为共同第一作者,我院首席专家马胜林教授与浙大医学院柯越海教授为共同通讯作者,肿瘤研究所科研骨干邱黎清、岳静等为主要作者。
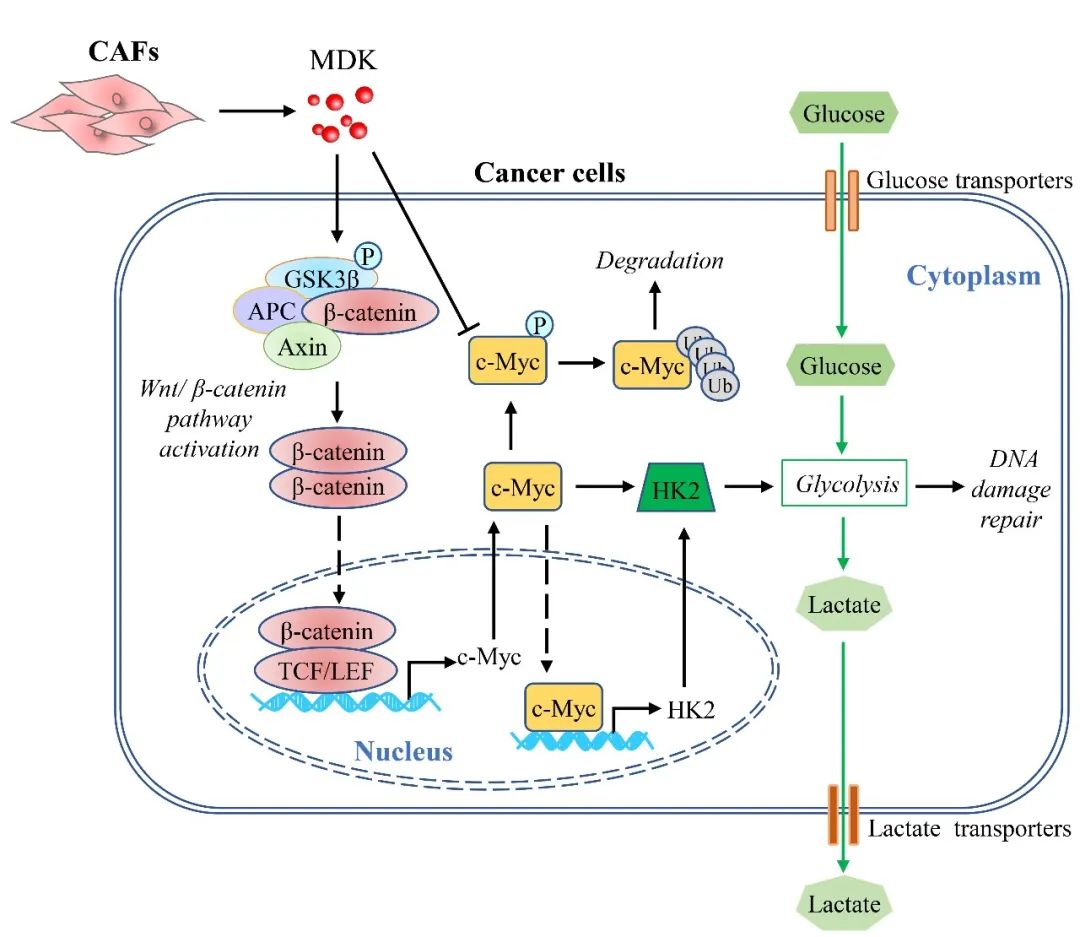
图 1. 研究过程示意图
放疗主要通过诱导DNA双链断裂从而促进癌细胞死亡,因此,DNA损伤修复决定了放疗后细胞的命运。
该论文采用细胞因子/趋化因子芯片高通量筛选发现CAFs通过分泌细胞因子Midkine激活Wnt/β-catenin信号通路,引起c-Myc高表达,同时降低c-Myc泛素化降解,从而促进NSCLC细胞的糖酵解。活化的糖酵解可显著地影响NSCLC细胞放疗后的DNA损伤修复响应,使得放疗引起的NSCLC细胞DNA损伤减少,而DNA修复则增加。
抑制由CAFs促进的糖酵解,可在体内外水平显著地增加NSCLC细胞的放疗敏感性。这些发现可能会为逆转CAFs促进的NSCLC细胞的放疗抗性提供新的线索,并为改善肿瘤放疗敏感性提供潜在的靶点。

该研究得到了国家自然科学基金、浙江省自然科学基金、杭州市医学高峰学科“肿瘤治疗学”等经费资助。
科研方向源自临床,科研成果服务临床患者。我院肿瘤研究所将一如既往地加深与临床科室的合作,共同致力于学科建设工作,从肿瘤的起源、早期诊断、个体化治疗、预后监测等多方面开展创新型研究,不断攀登医学高峰。










 返回
返回